Il Trapianto di rene: tecnica chirurgica
- Chirurgia “di banco”: la preparazione dell’organo
Un’accurata preparazione chirurgica dell’organo al trapianto, ovvero la cosiddetta chirurgia “di banco”, è di grande importanza ai fini della riuscita dello stesso. In un modello organizzativo di allocazione degli organi, che spesso prevede un programma di scambio tra diversi centri trapianto, è possibile che l’operazione di prelievo sia stata effettuata da un team chirurgico diverso da quello che eseguirà il trapianto. E’ quindi mandatorio che il rene sia ispezionato e preparato dai chirurghi che eseguiranno l’intervento sul ricevente, possibilmente prima che questo sia stato sottoposto ad anestesia generale. Tale operazione è eseguita mantenendo l’ipotermia dell’organo attraverso la sua immersione in soluzione di perfusione fredda (0-4 C°).
Essa consiste in primo luogo, dopo aver eseguito l’asportazione della capsula renale in una ulteriore e completa ispezione del parenchima renale, delle strutture vascolari e dell’uretere. In tale fase è quindi possibile l’identificazione di eventuali reperti patologici non segnalati all’esame ecografico sul donatore ed alla valutazione macroscopica del chirurgo prelevatore, quali: neoplasie, formazioni cistiche, ascessi, ematomi, calcoli, calcificazioni vascolari etc. Sarà quindi confermata l’idoneità definitiva dell’organo al trapianto e, se necessario, saranno effettuate biopsie.
Segue poi una preparazione chirurgica scrupolosa della vena e dell’arteria renale (in questa fase può essere modellato il patch aortico secondo le necessità) con legatura di eventuali collaterali, mantenendo una zona “di rispetto” a ridosso dell’ilo da non sottoporre a dissezione per non danneggiare rami arteriosi o venosi diretti al rene o alla porzione prossimale dell’uretere. La preparazione di quest’ultimo deve essere infatti particolarmente rispettosa della vascolarizzazione mantenendo ben rappresentato il grasso periureterale al fine di evitare fenomeni ischemici. Particolare attenzione verrà posta al riscontro di anomalie vascolari o urologiche (anomalie di numero o decorso dell’arteria, vena ed uretere) che possono condizionare le tecniche di anastomosi; verranno eseguite in questa fase le eventuali procedure di ricostruzione vascolare. In caso di arterie multiple, esse devono essere assolutamente preservate pena l’insorgenza di aree di necrosi parenchimale o, in caso di arterie polari inferiori, di ischemia dell’uretere. Se possibile le arterie devono essere incluse su un largo patch aortico di un donatore cadavere, oppure, in caso di donatore vivente o indisponibilità del patch, reimpiantate separatamete oppure anastomizzate tra loro prima del reimpianto. Un’arteria polare inferiore può essere occasionalmente anastomizzata all’arteria epigastrica inferiore. (1, 2)
- La preparazione del paziente
Da un punto di vista chirurgico il trapianto di rene deve essere considerato una procedura “semi-elettiva” e non urgente. Infatti, a differenza di altri trapianti di organi solidi come quello cardiaco ed epatico, in cui il fattore tempo è importante nel determinare le condizioni cliniche del ricevente che spesso si deteriorano nell’attesa, nel caso del trapianto renale la dialisi consente di mantenere il paziente in una situazione quasi “ottimale”.
Inoltre, a partire dalla fase dell’immissione in lista d’attesa e periodicamente fino al momento del trapianto, saranno messe in atto una serie di misure finalizzate al raggiungimento del miglior stato clinico preoperatorio. Esse comprendono terapie mediche, esami strumentali e procedure chirurgiche.
Le terapie mediche riguardano il controllo dell’ipertensione; la correzione dell’anemia; il trattamento delle alterazioni dell’equilibrio acido-base e di patologie metaboliche quali: l’iperparatiroidismo, il diabete mellito e l’ipercolesterolemia.
Tra gli accertamenti strumentali, di particolare importanza ai fini chirurgici risultano essere: l’esecuzione di uno studio vascolare accurato degli assi iliaco-femorali (mediante una o più delle seguenti metodiche d’immagine: TAC spirale, Angio-RM, Eco-Doppler), per verificare la presenza di stenosi o calcificazioni che possono ostacolare il clampaggio vascolare e l’esecuzione delle anastomosi ed uno studio anatomico e funzionale dell’apparato urinario.
Alcuni interventi chirurgici devono essere eseguiti in preparazione al trapianto, tra questi i più frequenti risultano essere: la colecistectomia in caso di litiasi; la nefrectomia mono o bilaterale in caso di reni policistici sintomatici e/o molto voluminosi; la paratiroidectomia in caso di iperparatiroidismo non responsivo alla terapia medica, estrazioni dentarie in caso di presenza di focolai infettivi odontogeni.
Non appena si rende disponibile un organo compatibile, il nefrologo di riferimento viene contattato per escludere l’insorgenza di controindicazioni nella storia clinica recente, soprattutto in riferimento ad episodi infettivi o all’aggravamento di condizioni morbose preesistenti.
Il paziente viene quindi ricoverato presso il centro trapianti per la valutazione preoperatoria. Essa comprende: una nuova anamnesi patologica prossima (con particolare riguardo all’esecuzione di recenti trasfusioni di sangue); l’ottenimento del consenso informato; l’esame obiettivo; gli esami ematochimici di routine preoperatori; una radiografia standard del torace in due proiezioni; un ECG. Vengono inoltre richieste e testate due unità di emazie concentrate.
Alcuni fattori devono essere presi in considerazione per decidere se il paziente dovrà essere dializzato subito prima dell’intervento chirurgico. Essi sono essenzialmente: il tempo intercorso dall’ultima dialisi; una determinazione clinica dello stato volemico; il riscontro di iperpotassiemia. In caso di necessità di un trattamento dialitico nell’immediato periodo preoperatorio, si avrà cura di non ridurre eccessivamente la volemia (mantenendo il paziente poco al di sopra del suo “peso secco”) per favorire la perfusione dell’organo al declampaggio e minimizzare l’utilizzo di eparina al fine di non alterare il profilo coagulativo del paziente e favorire l’emostasi chirurgica.
Viene attuata una antibiotico profilassi con antibiotici a largo spettro.
Il paziente viene posto sul letto operatorio in posizione supina, preferibilmente su un materassino riscaldatore. Particolare cura deve essere posta nella protezione dell’accesso dialitico attraverso un opportuno bendaggio protettivo, non compressivo, della FAV.
Dopo l’induzione dell’anestesia generale viene generalmente incannulata una vena centrale e posizionato un catetere di Foley con possibilità di riempire la vescica con soluzione salina per facilitare la fase dell’anastomosi uretero-vescicale. Calze elastiche compressive possono essere usate per ridurre il rischio di complicanze trombotiche postoperatorie. (2,3,4)
- La fase d’impianto
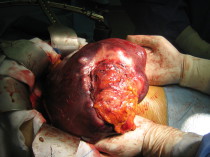
Il trapianto di rene è un trapianto eterotopico in quanto l’organo trapiantato viene allocato in sede extraperitoneale nella fossa iliaca del lato prescelto per l’impianto.
La scelta del lato è condizionata da alcuni fattori quali: precedenti interventi effettuati dal ricevente, compresi pregressi trapianti renali seguiti da espianto; situazione vascolare; esigenze di spazio in caso di pazienti con reni policistici sottoposti a nefrectomia; tipo di organo disponibile. All’inizio di questa attività chirurgica l’arteria iliaca interna era usata per l’anastomosi con l’arteria renale e si preferiva usare per un dato lato il rene controlaterale. Attualmente, vista l’alta percentuale di riceventi appartenenti alla quinta o sesta decade d’età, si preferisce usare l’arteria iliaca esterna; in questo caso viene scelto, preferibilmente, un rene omolaterale.
Il campo operatorio viene opportunamente irrigato con soluzione disinfettante, asciugato, delimitato da teli sterili e se possibile ricoperto con un telo adesivo trasparente.
L’incisione cutanea curvilinea, a forma di “J” o a “bastone da hockey”, oppure ad “esse italica”, è realizzata nella fossa iliaca prescelta partendo circa due dita traverse al di sopra della sinfisi pubica, per estendersi in alto verso la spina iliaca anteriore superiore terminando circa 2 cm medialmente ad essa.
L’accesso allo spazio retroperitoneale è realizzato attraverso un’incisione pararettale e la medializzazione del sacco peritoneale. Vengono sezionati i vasi epigastrici inferiori. Il legamento rotondo nella donna (che può essere anche sezionato), ed il funicolo spermatico nell’uomo, sono caricati su fettuccia e retratti verso il basso. In caso di necessità può essere eseguita una sezione con il bisturi elettrico dell’inserzione pubica del muscolo retto. Particolarmente utile per ottenere un campo operatorio facilmente accessibile e con una buona visibilità delle strutture vascolari, si è rivelato nella nostra esperienza l’utilizzo di un retrattore autostatico.
I vantaggi del posizionamento del graft in sede extraperitoneale sono essenzialmente: la riduzione dell’ileo postoperatorio; la relativa stabilità dell’organo che viene mantenuto in sede dal sacco peritoneale sovrastante che ne evita torsioni; la possibilità di tamponare contenere in sede extraperioneale eventuali sanguinamenti e raccolte urinose postoperatorie.
Segue a questo punto la preparazione chirurgica della vena e dell’arteria iliaca esterna, con rispetto dei tronchi nervosi che decorrono nelle loro vicinanze, per un tratto sufficiente al clampaggio ed all’esecuzione delle anastomosi. Le strutture linfatiche che circondano i vasi iliaci devono essere accuratamente legate al fine di evitare l’insorgenza di linfocele postoperatorio.
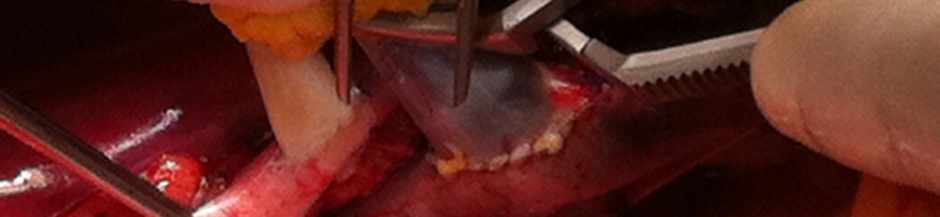
L’organo da trapiantare viene a questo punto estratto dal contenitore termico e può essere avvolto in una piccola garza laparotomica e sospeso all’interno del campo operatorio attraverso l’ausilio di due “nylon tape” assicurati ad una pinza di Kelly. Verrà periodicamente irrigato con soluzione fredda durante tutto il periodo della fase anastomotica fino al declampaggio, per mantenerne la temperatura di conservazione.
La successione delle anastomosi prevede per prima, dopo clampaggio (preferibilmente parziale laterale con pinza di Satinsky) della vena iliaca esterna e l’esecuzione di una venotomia, la realizzazione dell’anastomosi termino-laterale tra la vena renale e la vena iliaca esterna stessa con una sutura continua in prolene 5/0. Al termine della prima anastomosi, il posizionamento di un piccolo clamp vascolare (tipo “bulldog”) sulla vena renale in posizione parailare consente il declampaggio della vena iliaca senza rivascolarizzazione del rene, al fine di verificare la tenuta dell’anastomosi venosa e l’apposizione di eventuali punti staccati aggiuntivi o di presidi emostatici per controllare eventuali sanguinamenti.
In caso di utilizzo di un rene destro con vena renale particolarmente corta può essere talvolta necessario legare e sezionare la vena iliaca interna per facilitare la risalita della vena iliaca esterna oppure eseguire una plastica venosa d’allungamento utilizzando un segmento di vena cava del donatore.
L’anastomosi arteriosa è generalmente un’anastomosi termino-laterale tra l’arteria renale e l’arteria iliaca esterna, anch’essa realizzata in sutura continua con prolene 5 o 6/0, previo clampaggio totale, prossimale e distale, dell’arteria iliaca esterna stessa ed arteriotomia. Quando possibile, l’anastomosi arteriosa viene realizzata sfruttando la presenza di un patch aortico del donatore (Carrel patch) che ne agevola l’esecuzione e ne amplia il lume. La presenza di placche aterosclerotiche a volte può rendere inutilizzabile il patch aortico. Una variante di tecnica, come già detto in precedenza, prevede la realizzazione di un’anastomosi termino-terminale tra l’arteria renale e l’arteria ipogastrica.
A questo punto prima del declampaggio verrà somministrato al paziente un dosaggio di corticosteroidi.
Al declampaggio si assisterà alla riperfusione dell’organo e si eseguirà una revisione dell’anastomosi arteriosa e nuovamente di quella venosa e degli eventuali siti di sanguinamento parenchimale e del grasso periureterale. Dopo un controllo dell’equilibrio acido-base attraverso un’emogasanalisi e le opportune correzioni, sarà somministrata al paziente una dose variabile di furosemide per facilitare la ripresa della diuresi.
A questo punto verrà fatto passare l’uretere al di sotto del legamento rotondo o del funicolo spermatico, lo si renderà della lunghezza desiderata preservandone al meglio la vascolarizzazione e verrà eseguita una incisione sul versante posteriore al fine di ottenere un ampliamento della bocca anastomotica (cd. spatolatura).
Si eseguirà quindi l’uretero-neocistostomia. Questa può essere realizzata con diverse tecniche che prevedono tutte la creazione di un meccanismo antireflusso volto ad evitare l’insorgenza di infezioni ascendenti post-trapianto. Un tutore dell’anastomosi rimovibile, tipo doppio-J, è usato di routine in alcuni centri e rimosso generalmente dopo quattro/sei settimane, mentre altri ne riservano l’impiego solo nei pazienti a rischio di complicanze urologiche (5)
L’approccio più comunemente utilizzato prevede un’anastomosi extravescicale secondo la tecnica di Lich-Gregoir (6). La vescica viene dapprima distesa con soluzione salina per facilitarne l’identificazione e favorire l’estroflessione della mucosa ed il detrusore vescicale viene isolato dal grasso perivescicale. Viene quindi creato un tunnel separando il detrusore dalla mucosa per circa 2-4 cm, e poi la mucosa stessa viene incisa. Per evitare la formazioni di concrezioni litiasiche l’anastomosi viene confezionata con materiale riassorbibile (PDS: Polidiossanone) 4-5/0 in continua o a punti staccati. Successivamente i margini del detrusore vengono riapprossimati con 2 o 3 punti di sutura al di sopra dell’uretere a creare un meccanismo antireflusso.
Secondo la tecnica di Leadbetter-Politano (7), invece, la vescica viene aperta e l’uretere portato al suo interno attraverso un controapertura posteriore. Il tunnel sottomucoso viene realizzato lateralmente e l’uretere viene suturato alla vescica dall’interno. Segue la chiusura della vescica stessa.
Un terzo approccio descritto in letteratura consiste nella cosiddetta tecnica “double-stich” sec. Taguchi (8) (o “single-stich” sec. Shanfield) (9). In questo caso viene creato il tunnel ed incisa la mucosa stessa in analogia a quanto detto per la tecnica secondo Lich-Gregoir ed in aggiunta viene passato un punto ad “U” di materiale riassorbibile sul margine anteriore dell’uretere. Tale punto sarà poi fatto passare all’interno della vescica dall’incisione mucosa e fatto fuoriuscire attraverso la parete vescicale a circa 2 cm di distanza dal punto d’entrata; quindi legato all’esterno. Il detrusore sarà poi riapprossimato come nella tecnica sec. Lich-Gregoire.
Una variante di tecnica prevede l’anastomosi dell’uretere del rene trapiantato con l’uretere nativo ipsilaterale oppure, in caso di necessità, la creazione di un “conduit” ileale o colico. In caso di presenza di doppio uretere si rende necessaria la realizzazione di due anastomosi separate od in alternativa l’anastomosi preventiva a “bocca di pesce” tra i due ureteri per creare uno sbocco comune da anastomizzare in vescica (10).
Dopo un definitivo controllo dell’emostasi ed il posizionamento di un drenaggio chiuso in aspirazione tipo Jackson-Pratt si procede alla ricostruzione del piano muscolo-aponeurotico, del sottocute, e dello strato cutaneo(1,2,3,4) .
In relazione alla scarsità di organi, nel tentativo di utilizzare al meglio le risorse, alcuni reni provenienti da donatori anziani (età superiore a 60 anni) possono essere trapiantati entrambi nello stesso ricevente appartenente alla stessa fascia d’età nel quale si prevede un fabbisogno metabolico ridotto. Una biopsia pre-trapianto sarà effettuata per valutare l’effettiva idoneità del rene al trapianto “doppio”. Tecnicamente è possibile impiantare ciascun rene nella omologa fossa iliaca attraverso due incisioni separate oppure attraverso un’incisione mediana con accesso allo spazio properitoneale. In alternativa entrambi i reni possono essere collocati dallo stesso lato eseguendo le anastomosi del rene superiore con l’arteria iliaca comune e con la vena cava (11).
- Complicanze chirurgiche
Le complicanze chirurgiche post-trapianto hanno un grande impatto sulla sopravvivenza del paziente e del graft a lungo termine. Esse vanno pertanto tempestivamente diagnosticate e trattate al fine di preservare al meglio la funzione dell’organo. In caso di comparsa di sintomi che possono essere comuni a complicanze di tipo medico (es.: oligo-anuria, dolore, tensione, febbre etc..) è di fondamentale importanza escludere in primo luogo la presenza di una complicanza chirurgica prima di procedere all’istituzione di una terapia. A tal fine l’esecuzione di un esame ecocolordoppler è di grande aiuto e risolutivo nella gran parte dei casi.
Da un punto di vista tassonomico le complicanze chirurgiche possono essere distinte in base all’epoca d’insorgenza (intraoperatorie; postoperatorie precoci o tardive) oppure in relazione al distretto interessato (complicanze della ferita chirurgica; vascolari; urologiche).
Complicanze della ferita chirurgica
Esse comprendono fondamentalmente l’infezione e la deiscenza, eventi che possono talvolta essere sequenziali. L’incidenza di infezioni della ferita è progressivamente diminuita nel tempo, passando da circa un 25% negli anni 60/70’ a meno dell’1% dei nostri giorni (2). Tale miglioramento è dovuto a diversi fattori quali: il miglioramento delle condizioni generali e nutrizionali dei pazienti sottoposti a trapianto; l’uso di dosi inferiori di steroidi nella terapia postoperatoria e nel trattamento degli episodi di rigetto; l’applicazione di una meticolosa tecnica chirurgica asettica e l’istituzione di un’adeguata profilassi antibiotica. L’obesità ed il diabete costituiscono i principali fattori di rischio unitamente all’intensità della terapia immunosoppressiva. E’ noto il ruolo di alcuni farmaci immunosoppressori come la rapamicina nel determinare un ritardo della cicatrizzazione tessutale e favorire la deiscenza della ferita (12).
Le infezioni della ferita possono essere superficiali e/o profonde. Infezioni superficiali con deiscenza del solo piano cutaneo e sottocutaneo possono essere trattate con medicazione e contestuale drenaggio delle raccolte. Le infezioni profonde possono comportare necrosi dei piani muscolo-aponeurotici con formazione di raccolte asessuali sottofasciali che devono essere evacuate attraverso il posizionamento di un drenaggio eco o TC-guidato o tramite una revisione con toilette chirurgica. In entrambi i casi è di primaria importanza l’esecuzione di un esame colturale con antibiogramma al fine di indirizzare in modo corretto la terapia antibiotica sistemica. Una temibile conseguenza di un’infezione dei piani profondi può essere la contaminazione delle rime anastomotiche di sutura e la formazione di un aneurisma micotico (13,14).
Linfocele
Per linfocele s’intende la formazione di una raccolta di linfa nella neo-loggia renale, generalmente localizzata in posizione infero mediale rispetto al graft, proveniente dai piccoli linfatici che circondano i vasi iliaci lesionati durante la fase di dissezione. La sua prevenzione consiste quindi nell’uso di una tecnica chirurgica scrupolosa che preveda la legatura di tali strutture o l’utilizzo di particolari strumenti in grado di sigillare i piccoli linfatici quali il bisturi armonico (Ultracision®) o le pinze a radiofrequenza (Ligasure®).
L’incidenza di linfocele oscilla nelle varie casistiche dallo 0,5 al 20%; l’utilizzo di rapamicina può aumentare questa incidenza fino al 18-38% (12).
Un piccolo linfocele può restare completamente asintomatico ed essere svelato solo da un esame ecografico. In tal caso non è richiesto nessun trattamento ma sarà opportuno un follow-up ecografico della raccolta.
Linfoceli di dimensioni maggiori possono manifestarsi a distanza di giorni o settimane dal trapianto causando sintomi da compressione su diverse strutture. Possono comprimere l’uretere e provocare una sindrome ostruttiva urinaria; comprimere strutture vascolari come la vena iliaca conducendo a trombosi venosa profonda. Possono inoltre manifestarsi come massa addominale o scrotale e causare una fistola linfatica con fuoriuscita di liquido dalla ferita cutanea.
La diagnosi è essenzialmente ecografia e si basa sul riscontro di una lesione rotondeggiante, iperecogena a volte settata. Frequente è il riscontro di idronefrosi. Le caratteristiche ecografiche ed i dati clinici sono in genere sufficienti per fare una diagnosi, tuttavia a volte è richiesta una diagnosi differenziale con altri tipi di raccolte (urinomi, ematomi, ascessi). Il prelievo sterile per puntura e l’esame chimico fisico del liquido è dirimente in tali casi: un liquido chiaro con alto contenuto di proteine ed un valore di creatinina simile al siero depone per un linfocele. Prelievi ripetuti aumentano il rischio d’infezione che rappresenta una complicanza non infrequente di un linfocele
Il trattamento di un linfocele sintomatico consiste in prima battuta nel drenaggio esterno radioguidato attraverso un sistema chiuso. La completa risoluzione richiede generalmente un prolungato periodo di drenaggio e la recidiva dopo semplice puntura è un evento abbastanza frequente. L’istillazione di agenti sclerotizzanti (betadine, tetracicline, colla di fibrina, alcool) può concorrere all’obliterazione del cavo residuo e ridurre il tasso di recidiva. Con questa tecnica sono state segnalate percentuali di successo del 97%.
L’opzione chirurgica consiste in una marsupializzazione intraperitoneale che può essere realizzata per via tradizionale o laparoscopica. L’incisione della parete del linfocele deve in questo caso essere sufficientemente ampia da non consentire la sua successiva chiusura e rende il rene trapiantato un organo, a tutti gli effetti, intraperitoneale. L’esecuzione di una pileografia acendente può aiutare visualizzare il decorso dell’uretere trapiantato che viene depiazzato dalla raccolta al fine di evitarne la lesione iatrogena durante la creazione della breccia peritoneale (13-17).
Sanguinamento
Un fattore di rischio per il sanguinamento intra o postoperatorio è rappresentato dall’impossibilità di sospendere la terapia anticoagulante o antiaggregante prima dell’intervento chirurgico nei casi di trapianto da donatore cadavere. A parte i casi di pazienti portatori di valvole cardiache meccaniche, fibrillazione atriale e storia di ipercoagulabilità, molto spesso tale terapia nei dializzati cronici ha lo scopo, peraltro dibattuto, di prevenire la trombosi della fistola artero-venosa.
La prevenzione di tale complicanza risiede nell’accuratezza della tecnica chirurgica sia nella chirurgia su banco sia nella fase delle anastomosi vascolari. Infatti i siti maggiormente responsabili di emorragie sono le anastomosi arteriosa e venosa, l’ilo renale, le legature dei vasi epigastrici, la parete muscolare nel punto di passaggio del drenaggio, la sede di biopsie. L’emorragia da rottura del graft è un evento drammatico e può essere conseguente ad una trombosi venosa oppure ad un rigetto acuto o iperacuto.
La diagnosi si basa sui rilievi clinici che possono configurare quadri che vanno dallo shock emorragico in caso di emorragie massive, all’anemizzazione progressiva rilevata mediante l’esecuzione di emocromo seriati. La presenza di anomala quantità di sangue nel drenaggio chirurgico e/o il riscontro ecografico di un ematoma perirenale sono riscontri già sufficienti per una diagnosi tempestiva. Nei casi sospetti l’esecuzione di un esame TC spirale con fase angiografica o di un’angiografia digitale possono essere di grande utilità.
Le emotrasfusioni e la correzione di eventuali deficit coagulativi sono i presidi terapeutici fondamentali prima di ricorrere, se necessario, alla revisione chirurgica.
Emorragie tardive, particolarmente gravi, possono seguire alla rottura di un aneurisma micotico. In questi casi è spesso necessario l’espianto del rene, la riparazione arteriosa e, talvolta, la legatura dell’arteria iliaca esterna. In quest’ultima evenienza il confezionamento di un bypass extraanatomico provvederà a fornire il supporto ematico all’arto inferiore (2).
Stenosi dell’arteria renale
La stenosi dell’arteria renale è una complicanza tardiva che si verifica generalmente entro il primo anno, ma può redersi clinicamente evidente in un periodo che va da due mesi a due anni dal trapianto. L’incidenza riportata varia dall’1 al 23 % secondo i diversi AA. Tale variabilità riflette la non uniformità dei criteri usati per la diagnosi, sia essa strumentale o puramente clinica e la presenza o meno di significatività emodinamica.
Da un punto di vista topografico distinguiamo stenosi localizzate prossimalmente all’anastomosi arteriosa e dovute ad aterosclerosi dei vasi iliaci del ricevente oppure a lesioni da clampaggio che limitano il flusso ematico verso il graft (condizione denominata anche da taluni Autori: pseudostenosi dell’arteria renale); stenosi anastomotiche (50% circa di tutte le stenosi) dovute a placche presenti sul patch del donatore, ad un difetto di tecnica chirurgica, ad una reazione al materiale di sutura o a lesioni iatrogene provocate da una cannula durante la fase di perfusione su banco; stenosi postanastomotiche che possono instaurarsi in relazione a episodi di rigetto, rotazione, angolatura o compressione arteriosa.
Un’anastomosi termino-terminale ha un rischio tre volte maggiore di stenosi rispetto ad una termino laterale, soprattutto in presenza di una sproporzione di calibro tra i due vasi.
La presenza di una stenosi deve essere sospettata in caso di riscontro di ipertensione severa refrattaria alla terapia medica, eventualmente associata ad un soffio udibile sul graft, o ad una disfunzione d’organo non altrimenti spiegata.
La diagnosi strumentale si avvale della ultrasonografia Doppler. Alcuni criteri sono necessari per identificare una stenosi severa: velocità maggiore di 2m/sec; un gradiente di velocità tra il tratto pre e post stenotico maggiore di 2:1; marcata turbolenza post stenosi.
La angio-RM può essere impiegata con successo per la diagnosi si stenosi dell’arteria renale ed ha il vantaggio di non essere un esame invasivo e di non necessitare di un contrasto nefrotossico. L’angiografia rimane la metodica più sensibile per la diagnosi e permette allo stesso tempo il trattamento radiologico della stenosi.
L’angioplastica per cutanea transluminale con o senza posizionamento di uno stent offre una buona percentuale di successo (73%) in termini di mantenimento della pervietà e riduzione della pressione arteriosa e della creatinina. Nel 20% dei casi sono necessarie multiple procedure per ottenere un successo definitivo.
La correzione chirurgica della stenosi è riservata ai casi non risolvibili con la metodica percutanea ed è però gravata da un’alta percentuale di morbilità che comprende un 30% circa di perdita dell’organo trapiantato (20-25).
Trombosi del graft
Trombosi arteriosa e venosa possono complicare il decorso postoperatorio di un trapianto, manifestandosi nei primi giorni dopo il trapianto oppure fino a distanza di due mesi da esso.
La trombosi arteriosa può essere la conseguenza di un rigetto acuto, di un kinking, di un flap intimale o il risultato della una progressione di una stenosi.
La trombosi venosa può essere in relazione ad una condizione di ipovolemia marcata o dovuta compressione da parte di raccolte periilari (es.: linfocele). Entrambe possono riconoscere la loro genesi in un difetto nella tecnica chirurgica di confezionamento.
Fattori di rischio preoperatori sono tutti gli stati di ipercoagulabilità, la presenza di anticorpi anticardiolipina, ed una conta piastrinica superiore a 350x 10 9/L. L’incidenza di tali complicanze varia in letteratura dallo 0.5 al 8% (26%).
La presentazione clinica di una trombosi è caratterizzata dalla repentina cessazione della diuresi di un rene funzionante, con relativo immediato peggioramento degli indici di funzionalità, dolore ed aumento di volume del graft, ematuria e, in caso di rottura del rene, i segni dello shock ipovolemico.
All’ecodoppler una trombosi venosa si manifesterà con un rene di dimensioni aumentate, con assenza di segnale venoso ed aumento delle resistenze sul versante arterioso, fino al reperto di un’inversione del flusso in fase diastolica (26). Anche in caso di un infarto arterioso il rene sarà di dimensioni aumentate all’ecografia e fortemente ipoecogeno. La vascolarizzazione sarà completamente assente in tutto il parenchima in caso di infarto completo, mentre infarti segmentari si presenteranno come sfumate aree ipoecogene triangolari spesso delimitate da un orletto iperecogeno con assenza di flusso al loro interno.
Una scintigrafia renale in un rene con trombosi arteriosa dimostrerà l’assenza di perfusione e una ridotta o assente fase di escrezione.
Nei casi in cui i reperti ecografici sono dubbi una angio-RM o un’angiografia sono spesso dirimenti.
Una diagnosi precoce può consentire in una piccolissima percentuale dei casi il salvataggio dell’organo dopo una trombectomia, ma generalmente l’espianto del rene trapiantato è necessario. Alcuni successi sono stati descritti dopo terapia trombolitica intraarteriosa. Fattori determinanti nel salvataggio dell’organo risultano essere la causa e la durata dell’ischemia (27).
Fistola arteriovenosa e pseudoaneurisma
Una FAV intraparenchimale o uno pseudoaneurisma possono essere la conseguenza di una biopsia renale post-trapianto. La diagnosi è essenzialmente ecografica. Nel caso di una FAV essa consiste nella rilevazione di aree anomale di colore che si estendono oltre i profili dei vasi normali. L’arteria tributaria mostra uno spettro caratterizzato da alta velocità e bassa resistenza; mentre la vena efferente dimostra un flusso arterializzato. Nel caso di uno pseudoaneurisma il reperto è quello di una formazione cistica renale con un imponente flusso ematico intralesionale. La angio-RM è in grado di visualizzare e caratterizzare tali malformazioni vascolari iatrogene.
Il trattamento è indicato in caso di pseudoaneurismi con incremento volumetrico o FAV che determinano un peggioramento degli indici di funzionalità renale. Esso consiste nell’embolizzazione transarteriosa. La sede e le dimensioni delle malformazioni condizionano la scelta dell’agente embolizzante che può essere costituito da materiale gelatinoso riassorbibile (Gelfoam®) oppure da spirali d’acciaio. (28,29)
Fistola urinaria
Complicanze urologiche compaiono nel 4-8% dei trapianti renali (30-32). Le fistole urinarie e gli urinomi costituiscone generalmente problemi che insorgono nel periodo postoperatorio precoce in un rene funzionante oppure al momento della ripresa funzionale di un rene con “delayed graft function”.
La sede della fuoriuscita urinaria può essere la vescica, il sito anastomotico, l’uretere o i calici renali. Un “leak” dalla vescica può essere conseguente ad una deiscenza della sutura di chiusura vescicale nel caso di utilizzo di tecniche di anastomosi intravescicali. Una perdita dall’anastomosi è generalmente dovuta ad un difetto nella tecnica di confezionamento oppure alla necrosi ureterale distale conseguente alla devascolarizzazione in fase di prelievo o di preparazione chirurgica, o alla rottura dovuta ad un aumento di pressione seguente ad un’ostruzione. Una fistola caliceale è un evento più raro e può essere conseguente ad un infarto segmentarlo causato dalla legatura accidentale di un’arteria polare.
Se il drenaggio è ancora in sede la presenza di abbondante quantità di liquido nello stesso è diagnostica di per sé. Ogni fuoriuscita di liquido dalla ferita cutanea deve essere indagata con la determinazione della creatinina che risulterà più elevata di quella sierica in caso di fistola urinosa e presenterà il tipico odore “sui generis”. Gli urinomi possono variare per sede e dimensioni, generalmente si estrinsecano tra il rene e la vescica ma possono espandersi in sedi atipiche come lo scroto.
La sintomatologia clinica di una raccolta urinosa non drenata all’esterno comprende il riscontro di oliguria associato a tensione e dolore lancinante; tumefazione della regione perirenale; aumento di volume dell’arto inferiore omolaterale al trapianto; edema scrotale o delle grandi labbra.
La diagnosi ecografica di una raccolta anecogena può consentirne la puntura e la determinazione della creatinina. La scintigrafia renale dimostra lo “stravaso” del radiotracciante. La pielografia ascendente può fornire utili informazioni sulla sede della fistola ed indirizzare al suo trattamento.
Il posizionamento di un Foley rappresenta la prima misura da applicare in un paziente con una sospetta fistola urinaria.
Piccole fistole possono essere trattate con successo con il posizionamento, attraverso una nefrostomia per cutanea, di uno stent che viene mantenuto in sede generalmente per 6-8 settimane.
Il trattamento chirurgico è necessario negli altri casi ed è condizionato dalla sede della fistola e dalla disponibilità e vitalità dei tessuti.
In caso di leak ananstomotico la resezione distale dell’uretere con reimpianto è la soluzione migliore. In caso di impossibilità di utilizzare l’uretere per la presenza di necrosi estesa, si può optare per una uretero-pielostomia usando l’uretere nativo omolaterale o controlaterale. Una terza possibilità è fornita dalla cisto-pielostomia, nella quale la vescica è tubulizzata ed anastomizzata direttamente alla pelvi renale. Lo svantaggio di quest’ultima tecnica, nei confronti delle precedenti, risiede nella frequente occorrenza di infezioni ascendenti dovute alla mancanza di un sistema antireflusso (33). Qualunque sia la tecnica impiegata l’uso di un tutore doppio-J è consigliato.
Sindrome ostruttiva urinaria
Una ostruzione urinaria si manifesta in circa il 2% dei trapianti renali perlopiù come complicanza a medio termine, entro i primi 6 mesi dal trapianto. La sede dell’ostruzione è nel 90% il terzo distale dell’uretere, con una grande prevalenza del sito anastomotico. Le cause di una stenosi anastomotica possono ricondursi più frequentemente ad eventi cicatriziali secondari ad ischemia o rigetto, ad errori di tecnica, ad angolatura o compressione estrinseca da parte di raccolte (linfocele). Meno comunemente la stenosi è dovuta a fibrosi pelvica, litiasi, necrosi papillare, coaguli.
Da un punto di vista clinico una sindrome ostruttiva urinaria è caratterizzata da oligo-anuria, rialzo della creatinina, riscontro di dilatazione delle vie escretrici all’ecografia. La diagnosi differenziale con un rigetto cronico è talora difficile, potendosi trovare in quest’ultima condizione un certo grado di dilatazione caliceale associata ad i sintomi suddetti. Essendo il rene trapiantato denervato mancherà il riscontro della tipica sintomatologia dolorosa da colica renale e, per la mancanza del tono della muscolatura ureterale, un idronefrosi transitoria può comportare l’instaurarsi di una calicectasia persistente.
L’ecografia è in grado di dimostrare la dilatazione e talvolta la causa di essa come in caso di litiasi o linfocele. La scintigrafia può aiutare nella diagnosi dimostrando l’accumulo del tracciante nel sistema escretore.
La pielografia discendente, eseguita attraverso una nefrotomia con ago sottile, è in grado di confermare la diagnosi di ostruzione, di caratterizzare la stenosi, e di consentirne il trattamento attraverso una dilatazione pneumatica con palloncino semplice o meglio del tipo “cutting ballon” ed il conseguente posizionamento di stent ureterale. La stessa procedura può essere eseguita con approccio endoscopico transvescicale. Lo stent può essere lasciato in sede per un periodo variabile dalle 2 alle 6 settimane. Il tasso di successo globale di queste procedure raggiunge il 90%, con maggior efficacia in caso di stenosi recenti. Ostruzioni litiasiche possono essere risolte tramite estrazione per via endoscopica oppure per mezzo di una litotrissia extracorporea.
Stenosi del terzo medio o superiore secondarie a fenomeni ischemici, stenosi con estensione maggiore di 2 cm o comunque stenosi non risolte con trattamento non invasivo, richiedono la correzione chirurgica che si avvale delle medesime tecniche già descritte per la correzione di una fistola urinaria (34-43).
BIBLIOGRAFIA
1. Atlas of liver, kidney and pancreas
transplantation. DE Brunns, O. Terpstra, CE Broelsh Editors. Thieme.
2. Handbook of kidney transplantation. 4th ed. GM Danovitch Editor. Lippincott Williams & Wilkins 2005 Philadelphia, USA.
3. Il trapianto d’organo. FP Stuart, MM Abecassis, DB Kaufman Editors. Excerpta Medica 2002 S. Donato Milanese (Mi), Italy.
4. Handbook of organ transplantation. L Makowka, L Sher Editors. RG Landes Company 1995 Usa
5. Dominguez J, Clase CM, Mahalati K, et al. Is routine ureteric stenting needed in kidney transplantation. A randomized trial. Transplantation 2000;70:597-601.
6. Lich-Gregoir
7. Leadbetter-Politano
8. Taguchi
9. Shanfield
10. Churchill BM, Steckler RE, Mc Kenna PH, et al. Renal transplantation and the abnormal urinary tract. Transplant Rev 1993;7:21-25.
11. Bunnapradist S, Gritsch HA, Peng A, et al. Dual kidneys from marginal adult donors as a source for cadaveric renal transplantations in the USA. J Am Soc Nephrol 2003;14:1031-1036.
12. Langer R, Kahan BD. Incidence,therapy and cosequences of lymphocele after sirolimus-cyclosporine-prednisone immunosuppression in renal transplant recipients. Transplantation 2002;74:804-808.
13. Rubin RH. Infectious disease complications of renal transplantation. Kidney Int 1993; 44:221–236.
14. Baden L, Katz J. Infectious disease issues in the well transplant patient. Graft 2001; 4:276–289.
15. Catalona W, Kadmon D, Crane D. Effect of mini-dose heparin on lymphocele formation following extraperitoneal pelvic lymphadenectomy. J Urol 1980; 123:890–892.
16. Amendola MA, Montalvo BM. Percutaneous management of lymphoceles. In: Banner MP, Mitchell CW, eds. Radiologic interventions: uroradiology. Philadelphia, Pa: Lippincott Williams & Wilkins, 1998; 1487–1493
17. White M, Mueller P, Ferrucci J, et al. Percutaneous drainage of postoperative abdominal and pelvic lymphoceles. AJR Am J Roentgenol 1985; 145:1065–1069.
18. Kuzuhara K, Nishimori S, Kurooka Y, et al. Conservative treatment of lymphocele after renal transplantation, using 95% ethanol instillation. Transplant Proc 1994; 26:1988–1990.
19. Shokeir AA, el-Diasty TA, Ghoneim MA. Percutaneous treatment of lymphoceles in renal transplant recipients. J Endourol 1993; 7:481–485.
20. Rees CR, Palmaz JC, Becker GJ, et al. Palmaz stent in artherosclerotic stenoses involving the ostia of the renal arteries: preliminary report of a multicenter study. Radiology 1991; 181:507–514.
21. Jordan ML, Cook GT, Cardella CJ. Ten years of experience with vascular complications in renal transplantation. J Urol 1982; 128:689–692.
22. Dodd GD, Tublin ME, Shah A, et al. Imaging of vascular complications associated with renal transplantation. AJR Am J Roentgenol 1991; 157:449–459.
23. Beecroft J, Rajan D, Clark T, Robinette M, Stavropoulos S. Transplant renal artery stenosis: outcome after percutaneous intervention. J Vasc Interv Radiol 2004; 15:1407–1413.
24. Raynaud A, Lucino S, de Almeida Augusto MC, Beyssen B, Gaux JC. Percutaneous endoluminal angioplasty of the transplanted kidney: long term follow up. J Radiol 1994; 75:81–86.
25. Zajko AB, McLean GK, Grossman RA, et al. Percutaneous transluminal angioplasty and fibrinolytic therapy for renal allograft arterial stenosis and thrombosis. Transplantation 1982; 33:447–450.
26. Kaveggia LP, Parrella RR, Grant EG, et al. Duplex Doppler sonography in renal allografts: the significance of reversed flow in diastole. AJR Am J Roentgenol 1990; 155:295–298.
27. Reuther G, Wanjura D, Bauer H. Acute renal vein thrombosis in renal allografts: detection with duplex Doppler ultrasound. Radiology 1989; 170:557–559.
28. Boschiero LB, Saggin P, Galante O, et al. Renal needle biopsy of the transplant kidney: vascular and urologic complications. Urol Int 1992; 48:130–133.
29. Middleton WD, Kellman GM, Melson GL, et al. Post biopsy renal transplant arteriovenous fistulas: color Doppler versus US characteristics. Radiology 1989; 171:253–257
30. Kocak T, Nane I, Ander H, Ziylan O, Oktar T, Ozsoy C. Urological and surgical complications in 362 consecutive living related donor kidney transplantations. Urol Int 2004; 72:252–256.
31. Bennett LN, Voegeli DR, Crummy AB, McDermott JC, Jensen SR, Sollinger HW. Urologic complications following renal transplantation: role of interventional radiologic procedures. Radiology 1986; 160:531–536.
32. Mundy AR, Podesta ML, Bewick M, Rudge CJ, Ellis FG. The urologic complications of 1000 renal transplants. Br J Urol 1981; 53:397–402.
33. Platt JF, Rubin JM, Ellis JH. Distinction between obstructive and nonobstructive pyelocaliectasis with duplex Doppler sonography. AJR Am J Roentgenol 1989; 153:997–1000.
34. Tripathi M, Chandrashekar N, Phom H, et al. Evaluation of dilated upper renal tracts by technetium-99m ethylenedicysteine F+0 diuresis renography in infants and children. Ann Nucl Med 2004; 18:681–687.
35. Yong A, Ball S, Pelling M, Gedroyc W, Morgan R. Management of ureteral strictures in renal transplants by antegrade balloon dilatation and temporary internal stenting. Cardiovasc Intervent Radiol 1999; 22:385–388.
36. Soltes GD, Rainwater JR, Middlebrook MR, et al. Interventional uroradiology. World J Urol 1998; 16:52–61.
37. Pozniak MA, Dodd GD, Kelcz F. Ultrasonographic evaluation of renal transplantation. Radiol Clin North Am 1992; 30:1053–1066.
38. Tublin ME, Dodd G. Imaging of organ transplantation. Radiol Clin North Am 1995; 33:447–458.
39. Zanon E, Righi D, Robotti D, et al. The percutaneous treatment of the urological complications following kidney transplantation. Radiol Med (Torino) 1992; 84:613–618.
40. Cho DK, Zackson DA, Cheigh J, et al. Urinary calculi in renal transplant recipients. Transplantation 1988; 45:899–902.
41. Hefty T. Complications of renal transplantation: the practicing urologist’s role. AUA update series. Lesson 8, vol X. Linthicum, Md: American Urological Association, 1991; 58–61.
42. Karakayali H, Emiroglu R, Sevmis S, et al. Postoperative surgical complications in renal transplant recipients: one center’s experience. Transplant Proc 2001; 33:2683–2684.
43. Davari HR, Yarmohammadi H, Malekhosseini SA, Salahi H, Bahador A, Salehipour M. Urological complications in 980 consecutive patients with renal transplantation. Int J Urol. 2006 Oct;13(10):1271-5.